それをふまえて、今回はいよいよ「ベータ線」だよ。
ーーーーーーーーーーーーーーーーーーーーーーーー
いきなりですが、陽子と中性子の電荷は3分割されているのです。陽子の電荷は「2/3」と「2/3」と「-1/3」。中性子の電荷は「2/3」と「-1/3」と「-1/3」に分かれている。
 |
| 陽子は 2/3 + 2/3 - 1/3 =1、中性子は 2/3 - 1/3 - 1/3 =0 |
陽子は中性子になり・中性子は陽子になる。つまり、陽子と中性子が入れ替わる。
 |
| 陽子は「2/3」が「-1/3」に変わる。中性子は「-1/3」が「2/3」に変わる。 |
ーーーーーーーーーーーーーーーーーーーーーーーー
電荷の図を、もう少し詳しく描いてみよう。 |
| 陽子が中性子に変化する場合:-3/3に対して+3/3が生まれる。 |
 |
| 中性子が陽子に変化する場合:+3/3に対して-3/3が生まれる。 |
あたらしく生まれた「3/3」の電荷は、あっという間に壊れてしまう。
電荷を持つ「電子」と電荷を持たない小さな粒子に分かれちゃう。
右上方向に勢いよく飛んで行く「電子」たち。
彼らが「ベータ粒子」。
「3/3」の電荷には「+」と「ー」があるから、
それがはじけて出来た「ベータ粒子」にも2種類の電荷があります。
「+1」の陽電子と、「-1」の電子です。
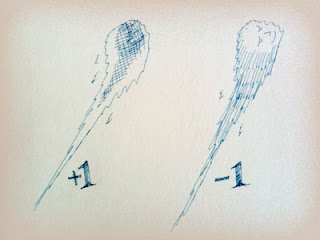 |
| 陽電子の電荷は+1、電子の電荷は−1 |
ーーーーーーーーーーーーーーーーーーーーーーーー
さて、この反応を実際の原子で見てみましょう。
陽子を53個持つ「ヨウ素131」の場合。ベータ粒子(電子)を放出して、陽子54個の「キセノン131」に変化します。
ベータ粒子とは、陽子と中性子が入れ替わるときに放出される電子または陽電子のこと。そして、ベータ粒子の流れが「ベータ線」です。
---

















